
Sandrine Voros, DR2 INSERM
Laboratoire TIMC
Equipe Gestes Médico-Chirurgicaux Assistés par Ordinateur (GMCAO)
Equipe Gestes Médico-Chirurgicaux Assistés par Ordinateur (GMCAO)


Chirurgie laparoscopique "augmentée"
Mon objectif est de concevoir un système pour la chirurgie laparoscopique "augmentée" qui :
- Est capable de localiser l'endoscope et les instruments du chirurgien
- Enrichit l’environnement à partir duquel le chirurgien va prendre ses décisions en lui permettant de voir « au-delà du visible » : ceci peut être réalisé en développent de nouveaux outils d’imagerie morphologique et fonctionnelle per-opératoires (qui vont par exemple mettre en évidence la capsule prostatique ou les cellules malignes)
- Fusionne les différentes modalités d'imagerie dans un référentiel unique
- Aide le chirurgien à prendre les « bonnes » décisions : il est communément admis que la courbe d’apprentissage de la chirurgie laparoscopique est longue (>100 chirurgies). Des travaux de recherche ont également démontré que la courbe d’apprentissage pour un bon contrôle du cancer après une prostatectomie radicale est d'~250 opérations.
Localisation et suivi d'instruments chirurgicaux par analyse d'images
Nous avons développé une méthode innovante pour la localisation 3D d'instruments chirurgicaux à partir d'images laparoscopiques (voir par exemple cet article). Cette méthode, qui fonctionne à ~12Hz a été validée au cours de différentes expérimentations sur banc d'essai. Elle est en cours d'amélioration pour satisfaire aux contraintes plus exigentes d'expérimentations sur spécimens anatomiques.
Cette méthode a été utilisée pour déplacer automatiquement le robot porte-endoscope ViKY® de la société EndoControl, par asservissement visuel de la pointe d'un instrument chirurgical. Elle a aussi permis de calibrer un robot ViKY® porte-endoscope et un second robot ViKY® utilisé comme porte-instrument, pour asservir un instrument chirurgical, bien que les deux systèmes ne soient pas rigidement liés (voir ici).
Cette méthode a été utilisée pour déplacer automatiquement le robot porte-endoscope ViKY® de la société EndoControl, par asservissement visuel de la pointe d'un instrument chirurgical. Elle a aussi permis de calibrer un robot ViKY® porte-endoscope et un second robot ViKY® utilisé comme porte-instrument, pour asservir un instrument chirurgical, bien que les deux systèmes ne soient pas rigidement liés (voir ici).
A gauche, le robot porte-endoscope ViKY® commercialisé par la société EndoControl.
A droite, vidéo illustrant le suivi d'instruments. L'axe et la pointe des outils sont détectés dans l'image (et permettent de retrouver la position 3D de l'instrument). Le robot porte-endoscope ViKY® et la caméra endoscopique étant calibrés, un asservissement visuel permet de garder la pointe d'un instrument ou de l'intersection de deux instruments au centre de l'image.
A droite, vidéo illustrant le suivi d'instruments. L'axe et la pointe des outils sont détectés dans l'image (et permettent de retrouver la position 3D de l'instrument). Le robot porte-endoscope ViKY® et la caméra endoscopique étant calibrés, un asservissement visuel permet de garder la pointe d'un instrument ou de l'intersection de deux instruments au centre de l'image.
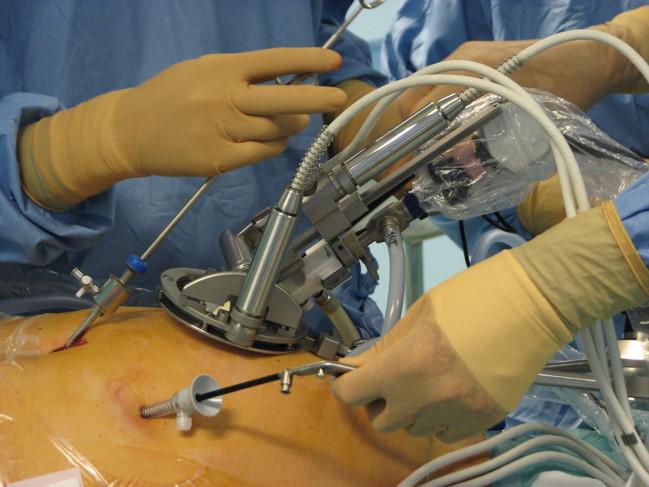
Voir au delà du visible
Dans le cadre du traitement du cancer de la prostate par chirurgie (prostatectomie radicale), le chirurgien cherche à réaliser une exérèse complète de la glande, tout en disséquant au plus près la capsule prostatique pour éviter les risques de lésion des structures voisines. Pour aider le chirurgien dans son geste, nous étudions trois pistes pour permettre au chirurgien de mieux voir son environnement chirurgical :
- la piste imagerie vidéo, car les images fournies par des mini-caméras CMOS offrent des perspectives intéressantes pour offrir un champ de vision plus large au chirurgien que l'image endoscopique. Nous avons notamment développé un "système de vision global" utilisant deux caméra CMOS placées comme des lunettes autour du trocart endoscopique (voir cet article)
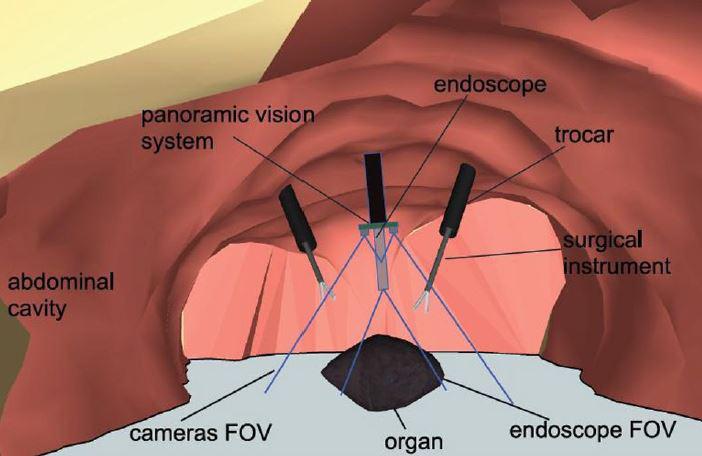

A gauche, le concept de vision globale. A droite, le premier prototype développé, comportant un système de déploiement simple.
- la piste imagerie échographique, car elle fournit des images volumiques et pourrait permettre d'imager la capsule prostatique et les bandelettes vasculo-nerveuses. Nous avons développé une sonde ultrasonore intra-urétrale motorisée qui prermet d'imager au coeur de la prostate (en collaboration avec la société VERMON)
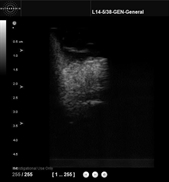

A gauche, la sonde intra-urétrale ultrasonore motorisée. A droite, une image obtenue avec l'échographe Ultrasonix.
- la piste imagerie de fluorescence car elle pourrait permettre de mettre en évidence la morphologie des tissus observés (tissus prostatiques ou non prostatiques, malis ou sains). Dans le cadre d'une collaboration, le laboratoire FEMTO-ST a développé un banc de mesure de fluorescence. Il permet de mesurer la fluorescence de copeaux de prostate frais (obtenus dans le cadre d'une recherche biomédicale)
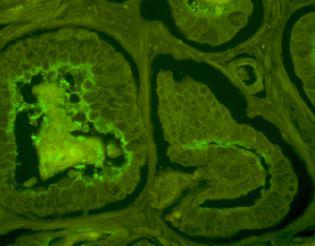
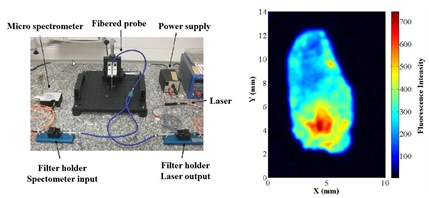
A gauche, observation de la fluorescence d'une coupe histologique de tissu prostatique au microscope confocal. A droite, le banc de mesure de fluorescence et la fluorescence en échelle de couleurs d'un copeau de prostate.
Ces matériels nous permettront de mettre au point nos techniques. Cet article résume les différents développements déjà réalisés grâce au financenement du projet DEPORRA par l'Agence Nationale de la Recherche dans le cadre de son programme TecSan 2009.
Fusion d'images
Afin que les informations multimodales puissent être exploitées de façon harmonieuse par le chirurgien (elles sont fournies dans des référentiels différents), il faut pouvoir les fusionner pour les afficher dans un référentiel unique. Nous avons déjà commencé à étudier la question de la fusion d'images laparoscopiques et ultrasonores. Pour fusionner deux modalités d'imagerie, il faut trouver des amers identifiables dans chacune des modalités, qui permettront de recaler les deux repères d'imagerie, c'est à dire calculer la transformation géométrique 3D rigide entre ces deux repères.
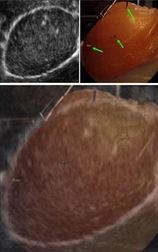
Dans le cadre de la prostatectomie radicale, une chirurgie des tissus mous, il est difficile de trouver de façon robuste des amers identifiables à partir des images seules. Nous étudions donc deux solutions d'amers artificiels plantés sur la prostate. La première, basée sur l'utilisation d'aguilles chirurgicales positionnées sur la glande prostatique, nous a permis d'effectuer manuellement un recalage avec une sonde ultrasonore endorectale du commerce, sur banc d'essai. La seconde est basée sur l'utilisation de "marqueurs actifs ultrasonores" (fabriqués par la société VERMON) qui peuvent être localisés par notre sonde ultrasonore intraurétrale.
Dans le cadre de la prostatectomie radicale, une chirurgie des tissus mous, il est difficile de trouver de façon robuste des amers identifiables à partir des images seules. Nous étudions donc deux solutions d'amers artificiels plantés sur la prostate. La première, basée sur l'utilisation d'aguilles chirurgicales positionnées sur la glande prostatique, nous a permis d'effectuer manuellement un recalage avec une sonde ultrasonore endorectale du commerce, sur banc d'essai. La seconde est basée sur l'utilisation de "marqueurs actifs ultrasonores" (fabriqués par la société VERMON) qui peuvent être localisés par notre sonde ultrasonore intraurétrale.
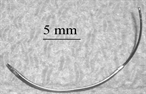

En haut, aiguille chirurgicale utilisée comme marqueur "passif". En bas, "marqueur actif ultrasonore".
Fusion d'un volume échographique endorectal avec une image laparoscopique à partir d'aiguilles chirurgicales localisées manuellement.
Aide à la décision chirurgicale
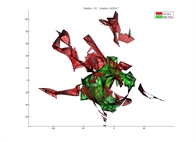
Les trois briques ci-dessus sont des éléments clefs pour être capable d’interpréter les gestes du chirurgien (la position de ses instruments chirurgicaux relativement aux structures pertinentes, dans un référentiel unique) et les comparer à une procédure chirurgicale « optimale », afin d’aider le chirurgien à prendre les « bonnes » décisions pour son patient (notamment pendant les 250 chirurgies initiales). Cette question a fait l'objet d'un doctorat (voir section encadrement) portant sur la « Quantification de la qualité d'un geste chirurgical à partir de connaissances a priori »). Une partie du travail a consisté à calculer des métriques à partir de la localisation temps-réel des instruments chirurgicaux (volume exploré, coordination, etc…), en vue de prédire l’expertise de chirurgiens à partir de leur réalisation de tâches précises (transfert d’objet, découpe, suture, …). L’expertise des chirurgiens était déterminée grâce aux méthodologies d’évaluation Global Operative Assessment of Laparoscopic Skills (GOALS) et McGill Inanimate System for Training and Evaluation of Laparoscopic Skills (MISTELS).
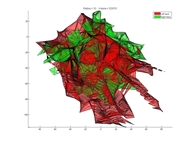
En haut, volume exploré par un chirurgien "expert" pour une tâche effectuée sur banc d'essai. En bas, volume exploré par un externe pour le même geste. On peut noter l'espace de travail réduit de l'expert.




